Tipovi hemijskih reakcija
Hemijske reakcije ili hemijske promene su promene tokom kojih od jedne ili više supstanci nastaju nove supstance. U toku hemijske reakcije dolazi do promena u strukturi polaznih supstanci ili supstance.
Kako možemo utvrditi da se dogodila neka hemijska reakcija ili hemijska promena?
- Pojava svetlosti

2. Promena boje

3. Izdvajanje gasa ↑

4. Pojava taloga ↓

Svaka hemijska reakcija se može skraćeno prikazati pomoću jednačina hemijskih reakcija. Svaka jednačina se sastoji od reaktanata (pišu se sa leve strane) i proizvoda ili produkata reakcije (pišu se sa desne strane). Reaktanti su od proizvoda reakcije odvojeni reakcionom strelicom koja nas upućuje na tok hemijske reakcije.
Svaka jednačina hemijske reakcije mora biti izjednačena, odnosno, broj atoma svakog elementa mora biti isti sa leve i desne strane reakcione strelice. Izjednačavanje se vrši tako što se pišu koeficijenti (indeksi se ne smeju menjati!), pri čemu se koeficijent 1 nikada ne piše.
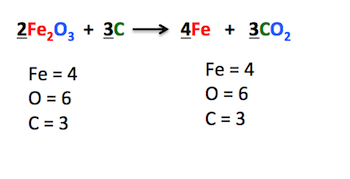
Prilikom prikazivanja jednačina hemijskih reakcija, moramo se pridržavati nekoliko pravila:
- Molekuli elemenata i jedinjenja zapisuju se svojim molekulskim formulama
H2, O2, N2, F2, Cl2, Br2, I2, H2O, NH3, HCl, CO2…….
- Metali, kao i nemetali koji grade molekule sa većim brojem atoma, zapisuju se simbolom hemijskog elementa
Na, Al, K, Mg, Ca, Fe, P, S, C…..
Na primer:
Prikazati jednačinu hemijske reakcije vodonika i kiseonika u kojoj kao proizvod nastaje voda.
- Prikazaćemo molekulske formule reaktanata i proizvoda
Vodonik i kiseonik se prikazuju kao H2 i O2, a molekul vode kao H2O. Obavezno pročitati šta su reaktanti, a šta su proizvodi ili proizvod reakcije. Ovde su reaktanti vodonik i kiseonik, a voda je proizvod reakcije.
- Sastavićemo jednačinu hemijske reakcije
H2 + O2 → H2O
- OBAVEZNO IZJEDNAČITI JEDNAČINU HEMIJSKE REAKCIJE
Sa leve strane imamo dva atoma vodonika, a toliko imamo i sa desne. Međutim, broj atoma kiseonika nije isti sa leve strane ih je dva, a sa desne jedan. Zato ćemo ispred formule vode napisati koeficijent dva, kako bismo imali po dva atoma kiseonika sa obe strane.
H2 + O2 → 2H2O
Međutim, sada imamo dva atoma vodonika sa leve, a četiri atoma vodonika sa desne strane sa desne (koeficijent i indeks se množe i tako se dobija ukupan broj atoma). Zato ćemo ispred formule molekula vodonika napisati dva, te ih tako dobiti četiri i sa leve strane (jer je dva puta dva, odnosno koeficijent puta indeks, jednako četiri).
2H2 + O2 → 2H2O
Sajt za vežbanje izjednačavanja jednačina hemijskih reakcija:
https://phet.colorado.edu/en/simulation/balancing-chemical-equations
Tipovi hemijskih reakcija
Osnovna tipovi hemisjkih reakcija su:
1) Sinteza (sjedinjavanje) je reakcija u kojoj od dve ili više čistih supstanci nastaju nove supstance.
2H2 + O2 → 2H2O
S + O2 → SO2
H2 + Cl2 → 2HCl
Fe + S → FeS
2) Analiza (razlaganje) je reakcija razlaganja čiste supstance na dve ili više čistih supstanci.
CaCO3 → CaO + CO2
2HgO → 2Hg + O2



